
ANALISIS BIOLOGICOS
Ensayo Sanitario - Enfermedades en semillas
6.3: Ensayo sanitario de semillas
Las siguientes son algunas Directrices específicas tal como las propone ISTA, para el análisis sanitario de muestras de semillas:
La mayor parte de los métodos indicados más adelante, se han desarrollado para muestras no tratadas. Generalmente no son válidos para semillas tratadas. Las descripciones detalladas deben considerarse únicamente como indicaciones en el empleo de los métodos.
I Cruciferas
a) Método de papel de filtro al 2,4 D
Muestra de trabajo: 1.000 semillas
Medio: Papel de filtro empapado a saturación mediante una solución al 0,2 por 100 de sal de sodio del ácido 2,4 diclorofenoxiacético, con el fin de inhibir la germinación de las semillas.
Incubación: Seis a once días de 18-20°C. Examen de Alternaria brassicae, A. brassicicola, Pboma lingam, Rhizoctonia solani y Sclerotinia sclerotiorum.- Después de seis días observar al microscopio con 20 6 25 aumentos, los conidios de Alternatia brassicae y A. brassicola sobre las semillas. Buscar después de seis días los filamentos libres del micelio plateado y los jóvenes primordios de picnidios de Phoma lingam, proceder a un segundo conteo después de diez u once días cuando los picnidios del hongo se han desarrollado sobre las semillas y a menudo en el papel circundante.
II Gramineas (especificadas)
a). Método en papel de filtro para Avena sativa, Hordeum vulgare, Oriza sativa, Secale cereale y Triticum aestivum
Muestra de trabajo: 400 semillas. Medio: Papel de filtro húmedo, colocado en un recipiente cerrado con el fin de mantener una humedad elevada; distancia entre las semillas: 20 mm por lo menos.
Incubación: Incubar la cebada a 20°C durante ocho días, el arroz a 22°C durante seis días, el centeno a 10°C durante cuatro días, después a 20°C durante tres días y el trigo a 10°C durante catorce días. Para estimular la esporulación de algunos hongos, se recomienda para la cebada, arroz y centeno la ultra-violeta (luz negra). Para el trigo es preferible la oscuridad durante el período relativamente largo de incubación a baja temperatura que se requiere para Septoria nodorum
Examen: Observar al microscopio con débil aumento: la cebada especialmente para Drechslera graminea, D, teres, D. sativum, Fusarium nivale y otros Fusarium spp, el arroz especialmente para Drechslera oryzae, Pyricularia oryzae y Trichoconis padwickii, el centeno especialmente para Fusarium nivale, F graminearum y Drechslera sorokiniana; y el trigo especialmente para Septoria nodorum, Fusarium nivale, F graminearum y Drechslera sorokiniana.
b. Método en agar para los cereales.
Muestra de trabajo: 400 semillas.
Pretratamiento: Sumergir las semillas, durante diez minutos en una solución de hipoclorito sódico que contenga aproximadamente 1 % w/w en peso de cloro libre, después decantar el líquido.
Medio y preparación: Agar al 2 % de extracto de malta, en cajas Petri de 95 mm, diez semillas por caja.
Incubación: Seis días a 22°C (280C para D. Victoriae) Examen de: Fusarium spp., Drechslera avenae, D. sorokiniana y D. victoriae, Observar a simple vista las colonias características de hongos. Puede ser necesario un microscopio, sobre todo para la determinación y control de especies de Fusarium.
c). Método de los embriones para Ustitago nuda (carbón desnudo) en Hordeum vulgare.
Muestra de trabajo: Por lo menos 2.000 semillas si el porcentaje de infección tolerado es de 0.2 % o menos.
Preparación: Se han descrito diversos métodos de remojo (con NaOH) y de extracción de embriones (mediante un juego de tamices) y se empleará según el estado de las semillas por ejemplo cuando los embriones se rompen o no se separan fácilmente de los granos. Las muestras de semilla se comportan de manera variable según las condiciones de recolección v la variedad.
Examen: Observar los embriones así preparados con un microscopio de débil aumento y buscar el micelio característico de Ustitago nuda en la región del escutelo del embrión.
III. Leguminosas: Pbaseolus vulgaris y Pisum sativum
a) Método en papel filtro,
Muestra de trabajo: 400 semillas.
Medio: Papel filtro (papel doblado) saturado de agua con el fin de mantener una humedad elevada distancia entre semillas: 120 mm por lo menos; envolver los papeles filtro en paquetes o rollos.
Incubación: Ocho días a 20°C.
Examen: Observar con un microscopio de pocos aumentos, los guisantes, especialmente para Ascochyta spp y las judías para Colletotrichum lindemuthianum.
b) Método en agar.
Muestra de trabajo: 400 semillas.
Pretratamiento: Sumergir las semillas durante diez minutos en una solución de hipoclorito sódico que contenga aproximadamente 1 % w/w en peso de cloro libre, después decantar el líquido.
Medio y preparación: Agar al 2 % de extracto de malta en cajas Petri de 95 mm cinco semillas por caja.
Incubación: Cinco días a 20°C.
Examen: Buscar Ascochyta spp. y Fusarium spp., en los guisantes y Colletotrichum lindemuthianum y Fusarium spp en las judías.
IV. Linaceas: Linum usitatissimum
a) Método en papel filtro
Muestra de trabajo: 400 semillas
Medio: Papel de filtro húmedo, colocado en un recipiente cerrado con el fin de mantener una humedad elevada; distancia entre las semillas: 20 mm. por lo menos,
Incubación: Seis días a 20°C.
Examen: Buscar los hongos enumerados a continuación en
b) Método de agar a excepción de Polyspora lini, que no puede ser detectado en la duración de este ensayo.
Muestra de trabajo: 400 semillas.
Medio de preparación: Agar al 2 % de extracto de malta, en cajas Petri de 95 mm, diez semillas por caja.
Incubación: Cinco a siete días a 22°C.
Examen: Relativo a Botrytis cinerea, Alternaria linicola, Ascochyta íinicola (Phoma sp.), Colletotrichum lini, Fusarium lini¡ y Polvspora lini.
Después de tres días buscar en el substrato Botrytis cinerea. Después de cinco días buscar las colonias características de otros hongos patógenos. Si las semillas se ensayaran después de un tratamiento por fungicida, la última observación se efectuará después de siete días en lugar de cinco. Las semillas se examinarán a simple vista, aunque en algunos casos es necesario comprobar el examen a simple vista por una observación al microscopio.
V. Umbelliferas: Apium graveolens, Daucus carota y Petroselinum crispum
a) Método en papel filtro.
Muestra de trabajo: 400 semillas.
Medio: Papel filtro húmedo, colocado en un recipiente cerrado con el fin de mantener una humedad elevada; distancia entre las semillas 20 mm por lo menos.
Incubación: diez días a 18-22°C.
Exámenes de Stemphylium radicinum, Alternaria porri f. sp. dauci y Phoma rostrupii: Observar con una lupa binocular.
b) Otro método en papel filtro
Muestra de trabajo: 400 semillas.
Medio: Papel de filtro húmedo; repartir las semillas a razón de unas 200 por caja Petri de 95 mm.
Incubación: Una a dos horas aproximadamente.
Examen de Septoria spp. y Phoma spp. Observar con una lupa binocular. Cada semilla se examinará en todas sus caras respecto a los picnidios de Septoria spp. y de Phoma spp.
|
|
|
| Caja de Petry con colonia de bacteria | Caja de Petry con cultivo de hongos |
 |
 |
|
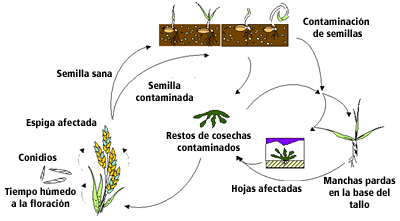
Ciclo de Fusarium |
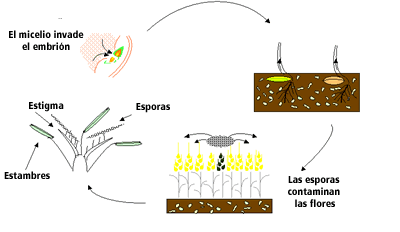
Ciclo de Ustilago
|
|
|
|
| Imagen 1: Ubicación del inóculo o cuerpos fructíferos en semilla de trigo |
Imagen 2: Ubicación del inóculo o cuerpo
fructífero en semilla de cebada
|
|
|
|
| Imagen 3: Síntomas de Fusarium (trigo) | Imagen 4: Síntoma de Penicilium ( trigo) |
|
|
|
|
Imagen 5: Síntomas de Septoria en semilla y
espiga (trigo)
|
Imagen 6: Síntomas de Tilletia (trigo)
|
|
|
|
| Imagen 7: Síntoma de Cercospora sp (soja) | Imagen 8: Síntomas de Phytium (soja) |
|
|
|
|
|
|
| Imagen 11: Síntoma de Penicillium (maíz) | Imagen 12: Síntoma de Penicillium (maíz) |
|
|
|
| Imagen 13: Síntoma de Diplodia (maíz) | Imagen 14: Síntoma de Diplodia (maíz) |
|
|
|
| Imagen 15: Esclerotos de Esclerotinia sp (girasol) | Imagen 16: Síntomas de Giberella (maíz) |
|
|
|
| Imagen 17: Síntoma de Fusarium (maíz) | Imagen 9: Síntoma de Fusarium (maíz) |
|
|
|
| Imagen 10: Síntoma de Fusarium (maíz) | Imagen 18: Síntoma de Ustilago (maíz) |