|| Sistemas Reproductivos || Variabilidad en Semillas || Variabilidad en Frutos || Glosario ||
A continuación se describen ejemplos de las categorías de anormalidades que se encuentran con mayor frecuencia en cada una de las familias más importantes, y constituyen una guía para la aplicación de estas reglas a las plántulas de estas familias.'
(Ver diagramas)
1. Raíz adventicia - La raíz que procede de una estructura distinta de una raíz.
2. Yema axilar - Yema en la axila de una hoja.
3. Brote axilar - Brote que se desarrolla a partir de una yema axilar. Ej. raíz que procede de
un tallo.
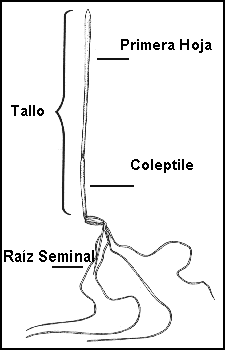
4. Coleoptilo - Envoltura que rodea y protege el brote en el embrión y plántula de las
Gramineas
5. Tejido conductor - El principal tejido de la planta por el que circula agua y sustancias
nutritivas.
6. Cotiledón - Hoja de la semilla - primera o primeras hojas de un embrión y plántula, no es
una hoja foliar.
7. Podredumbre - Descomposición del tejido orgánico generalmente asociado a la presencia
de microorganismos.
8. Dicotiledóneas - Grupo de plantas fanerógamas así denominadas porque el embrión normal-
mente tiene dos cotiledones.
9. Decoloración - Alteración o pérdida de color
10. Enfermo - Que muestra el efecto de la presencia de un organismo patógeno o una
actividad fisiológica anormal.
11. Embrión - Planta joven parcialmente desarrollada, generalmente contenida en una
semilla.
12. Endospermo - Tejido nutritivo que se encuentra en algunas semillas.
13. Epicotilo - Parte del tallo de la plántula situada inmediatamente encima de los
cotiledones y por debajo de la hoja primaria.
14. Germinación epígea - Un tipo de germinación en la cual el cotiledón (es) aparece (n)
sobre la superficie del suelo.
15. Hipocótilo - La parte del tallo de la plántula situada entre los cotiledones y la raíz primaria
16. Germinación hipógea - Un tipo de germinación en la cual el cotiledón (es) permanece (n) bajo la
superficie del suelo.
17. Infección - entrada y dispersión de organismos patógenos en un material vivo (ej.
estructuras de la plántula) que frecuentemente (no siempre) causan síntomas
de enfermedad y decaimiento
primaria: el organismo patógeno está presente y vivo en la misma semilla
secundaria: el organismo patógeno es dispersado pdesde otras semillas
o plántulas.
Infectado - Que transporta el organismo patógeno, pero no presenta necesariamente los
síntomas de la enfermedad.
18. Raíces laterales - Raíz que procede de otra raíz.
19. Mesocótilo - En algunas monocotiledóneas, la parte del tallo de la plántula que se
prolonga por debajo del brote.
20. Monocotiledóneas - Grupo de plantas fanerógamas, así denominadas, porque el embrión
normalmente tiene un cotiledón.
21. Pericarpio - En algunas especies aquella parte de la semilla, que procede de las paredes
del ovario engrosadas.
22. Fitotóxico - Tóxico para las plantas.
23. Plúmula - Propiamente el brote inicial del embrión, pero se usa en ensayos de semillas,
para designar la yema terminal de la plántula.
24. Hoja primaria - La primera hoja verdadera de la plántula
25. Raíz primaria - La raíz que se desarrolla directamente de la radícula.
26. Radícula - La raíz inicial del embrión
27. Pelo radical - Una fina pilosidad de la raíz, que absorbe agua y sales minerales del suelo.
28. Escutelo - Cotiledón de las Gramineas
29. Raíz secundaria - Término usado en ensayos de semillas, para designar raíces distintas de la
raíz primaria.
30. Tegumento / Testa - La cubierta más externa de una verdadera semilla.
31. Plántula - Planta joven que se desarrolla a partir de una semilla.
32. Raíz (es) seminal (es) - Raíz (es) del embrión o de la plántula joven de las Gramineas
33. Yema apical - Usado en ensayos de semillas, para designar el principal punto de
crecimiento del tallo de la plántula.
34. Testa - Ver 30.
35. Geotropismo - Crecimiento de la planta en respuesta a la gravedad.
positivo: crecimiento hacia abajo (ej. raíz primaria normal)
negativo: crecimiento hacia arriba (ej. tallo normal)
Hay tres categorías principales de anormalidades: lesiones, deformaciones y podredumbres. Estas anormalidades pueden clasificarse más detalladamente como se indica a continuación.
Ia. Carencia de raíces o sólo una raíz seminal en Avena, Hordeum, Secale y Triticum.
Ib. Raíz primaria (o raíces seminales en Gramíneas) corta y atrofiada.
Ic. Raíz primaria delgada y débil, ya sea corta o larga.
Id. Raíz primaria corta y atrofiada. corta y débil, o filiforme: raíces laterales y adventicias
débiles
Ie. Carencia de raíz primaria o de raíces laterales o adventicias bien desarrolladas.
If. Raíces semanales cortas y débiles, filiformes o acuosas.
Ig. Raíz primaria hendida longitudinalmente o dañada, con raíces adventicias y laterales
débiles.
Ih. Raíz primaria sin pelos radicales.
Ii. Raíz primaria de color marrón.
IIa. Hipocótilo corto y grueso o retorcido, en forma de S, o acuoso.
Ilb. Epicotilo con constricción, lesión granulada, o hendidura abierta que probablemente
interfiera los tejidos conductores.
lIc. Hipocótilo con constricción, lesión granulada o hendidura abierta que probablemente
interfiera los tejidos conductores.
IId. Epicotilo corto y grueso o retorcido alrededor de] eje principal. o en forma de S.
lIe. Carencia de yema termina].
lIf. Dos brotes cortos y débiles, o filiformes.
lIg. Carencia de hojas primarias con o sin yema apical o yemas axilares, o carencia de más
de la mitad de la superficie total de las hojas primarias o incapaz de funcionar normal-
mente, o sin una hoja primaria y daño evidente en la yema apical.
llIa. Carencia de hojas primarias.
IIIb. Hojas primarias cortas, cuya longitud sea inferior a la mitad de la longitud del coleoptilo.
lIlc. Hojas primarias destrozadas o con hendiduras longitudinales y/o coleoptilo con una
hendidura fácilmente apreciable a simple vista o coleóptilo con un desarrollo anormal
debido a algún daño.
IIId. Coleóptilo y hojas primarias filiformes o pálidos, o acuosos.
lIIe. Coleóptilo y hojas primarias cortos y gruesos, generalmente con raíces seminales cortas
o atrofiadas.
IIIf. Carencia de coleóptilo o desproporcionadamente corto.
IVa. Carencia de cotiledones.
IVb. Un cotiledón, con daño evidente en la yema apical.
IVc. Hoja similar al cotiledón en Allium, pobremente desarrollada sin "Rodilla"
(ángulo) bien definida.
(IVd).
IVe. Cotiledones con necrosis fisiológicas - como en lVh.
IVf. Cotiledones de color gris - corno en IVh.
IVg Cotiledones hinchados y ennegrecidos.
lVh. Más de la mitad de la superficie total de los cotiledones partida o cubierta con
anchas o zonas oscuras, o con hendiduras abiertas si el desarrollo total es
desproporcionado comparado con el de una plántula normal que haya germinado al
mismo tiempo.
Va. Cotiledones podridos.
Vb. Hipocótilo podrido.
Vc. Epicotilo o tallo podrido.
Vd. Plúmula podrida o podredumbre en el punto de unión entre la plántula y el endospermo,
o decoloración del coleoptilo que haya penetrado hasta las hojas.
Ve. Raíz primaria (excepto infección secundaria por Phoma betae) o raíces seminales en las
Gramíneas podridas.
Vf. Punto de unión entre los cotiledones y el eje de la plántula, o la zona adyacente a la
yema apical podrido o descolorido, si el desarrollo total es desproporcionado comparado
con el de plántulas normales del mismo cultivar que hayan germinado al mismo tiempo.
Vg. Plántula completamente podrida.
VIa. Plántula corta y débil. filiforme, acuosa. o con un desarrollo desequilíbrado de las
principales estructuras.
VIb. Plántula dañada por el hielo con el coleoptilo o plúmula granulados v hojas primarias
débiles y retorcidas en espiral.
VIc. Plántulas en las que el color verde no se desarrolla.
Vld. Plántula totalmente destrozada.
VIe. Cotiledones desarrollados, pero hipocótilo corto y carencia de raíces.
VIf. En Confieras, plántulas que presentan los cotiledones desarrollados desde el micrópilo, o la
radícula desarrollada desde una parte de la semilla distinta del micropilo.
Estas categorías están descritas de forma más detallada en el Handbook for Seedling Evaluation.
Utilización de papel como sustrato
a. Muestra de referencia. Al hacer el pedido la estación de ensayos de semillas deberá enviar una muestra de referencia y el papel suministrado deberá ser por lo menos de las mismas características.
b. Muestreo. Se tomará al azar el 5 % de los paquetes del envío y de cada uno de ellos una muestra de cuatro hojas de papel, para su examen ensayo. No se tomarán menos de 20 hojas ni más de 80.
c. Dimensiones, número de hojas y embalaje. Las dimensiones de las hojas y el número de ellas por paquete se especificará al hacer el pedido. El embalaje deberá proteger el contenido de toda suciedad y deterioro durante el transporte y almacenamiento.
d. Estructura. El papel deberá tener una estructura suelta, porosa y estará exento de defectos o impurezas susceptibles de modificar su utilidad.
e. Ausencia de gérmenes. Todos los substratos de papel estarán exentos de hongos y de bacterias que puedan interferir el desarrollo o la apreciación de las plántulas en germinación. La esterilización de los substratos de papel puede ser necesaria en los laboratorios situados en clima tropical.
f. Tratamiento. El fabricante no podrá tratar el papel para eliminar los moho, ya que esta operación podría depositar substancias químicas en el papel. que harían desaparecer o destruirían los organismos patógenos de las semillas.
g. Substancias perjudiciales. El papel no contendrá substancias tóxicas en cantidades susceptibles de perjudicar el desarrollo de las raíces en el ensayo biológico relativo a las substancias perjudiciales.
h. Composición. Las fibras estarán constituidas en un 100 % de celulosa de madera blanqueada químicamente, de algodón, o de cualquier otra celulosa vegetal purificada.
i. Color. El papel puede ser blanco o coloreado por una substancia no tóxica para las plántulas en germinación.
j. Textura. La textura del papel será tal que las raíces de las plántulas en germinación se desarrollen en la superficie y no penetren en el interior del papel. Es preferible una superficie rugosa para el papel filtro y toallas.
k. Espesor del substrato húmedo. El espesor total del substrato húmedo no deberá ser inferior a 2 mm. aproximadamente.
Especificaciones detalladas
a. Papel secante v papel filtro. Las características que se citan a continuación se recomiendan para el papel secante y el papel filtro (determinadas al 50 por 100 de humedad relativa). Cuando el papel secante se mide con un 65 % de humedad relativa en lugar de un 50%, el peso unitario es 30% más elevado y la fuerza de ruptura 10% más débil aproximadamente. Probablemente ocurre lo mismo para el papel filtro.
|
Tipo de papel |
Peso |
Peso (1) Unitario |
Fuerza de ruptura (mínima) |
Ascensión capilar (mínima) |
Acidez |
Cenizas (máxima) |
|
|
|
grIM2 |
KNIm2 |
mm |
Ph |
% |
|
Secante |
Ligero |
270 |
180 |
30 |
6,0-7,5 |
1.0 |
|
|
Medio |
405 |
220 |
30 |
6,0-7,5 |
1,0 |
|
|
Pesado |
730 |
320 |
30 |
6,0-7,5 |
1,0 |
|
Filtro |
Ligero |
85 |
90 |
30 |
6,0-7,5 |
1,0 |
|
|
Medio |
132,5 |
100 |
30 |
6,0-7,5 |
1.0 |
|
|
Pesado |
170 |
120 |
30 |
6,0-7,5 |
1,0 |
(1) Tolerancia relativa al peso unitario de papel secante: 5 %
Tolerancia relativa al peso unitario de papel filtro: + 10'%
b. Toallas de papel. Las características que se citan a continuación referentes a las propiedades físicas y químicas de las toallas de papel, han sido consideradas corno satisfactorias en ciertos países, pudiendo servir de guía para las estaciones que deseen emplear toallas de papel como substrato.
![]()
Núm. de la Pesos Fuerza de Ascensión Acidez Cenizas
muestra Unitarios ruptura capilar
gIM2 KN/m2 mm Ph %
![]() T-11
128,5 478 58
6,7 0.51
T-11
128,5 478 58
6,7 0.51
T-21 64,7 267 52 6.4 0,48
T-42 135,1 105 32 6,5 0.62
![]()
1 Estas toallas se emplean en los Estados Unidos. Se pueden encontrar detalles relativos a las especificaciones en los "Proc. Ass. off. Seed Analysis N. Am, 52, 41-42. 1962".
2 Estas toallas se emplean en Hungría. Se pueden obtener detalles relativos a las especificaciones dirigiéndose al Director de¡ Instituto de Análisis de Semillas del Estado, H-1525 Budapest 114. PO Box 93, Hungría.
Métodos de ensayo
a. Ensayo biológico relativo a las substancias nocivas.
Este ensayo se puede efectuar por comparación de un papel de calidad desconocida con un
papel de calidad reconocida como buena. Se recortarán los trozos de papel a las dimensiones convenientes y se colocarán en Cajas Petri u otros recipientes. Colocar en cada recipiente dos capas de papel secante o cuatro capas de toallas de papel o de papel filtro. Humedecer los papeles con agua de grifo, utilizando sólo el agua suficiente para su saturación (que no haya que eliminar un exceso de agua). Las raíces de las especies de semillas que se citan a continuación están reconocidas como sensibles a la toxicidad del papel: Phleum pratense, Agrostis aurantea y Festuca rubra var. commutata. La valoración del papel se hará comparando él desarrollo radicular de las plántulas germinadas sobre el papel de calidad desconocida y el de aquellas que han germinado sobre el papel testigo. Hacer la valoración dentro de los días especificados en el cuadro 6.1. A para el primer conteo de la especie de semilla empleada para el ensayo, dado que los síntomas de inhibición débil de la raíz son más pronunciados en un estado precoz de su desarrollo. En los estados posteriores del crecimiento, la formación de las raíces secundarias puede enmascarar los síntomas de inhibición de la raíz, que son evidentes al principio del ensayo. Los síntomas de una inhibición de la raíz debidos a la toxicidad del papel son: extremos de raíz acortados y a veces descoloridos, raíces levantadas por encima del papel, pelos radicales entrelazados y a veces plúmulas acortadas.
b. Ascensión capilar.
Cortar cuatro tiras de papel de 10 mm de ancho cada una, dos en el sentido de la fabricación y dos en el sentido perpendicular al precedente. Introducir cada tira en agua destilada o desionizada, una longitud de 20 mm aproximadamente a partir del extremo de cada tira. Después de dos minutos, medir eón una aproximación de 1 mm la altura que ha alcanzado el agua en la tira. Calcular la media de dos tiras cortadas en el sentido de la fabricación y la media de dos tiras cortadas en la dirección perpendicular. Tomar como resultado del ensayo la media inferior.
c. Otros métodos.
Los ensayos que se citan a continuación se realizarán de acuerdo con los métodos recomendados por la 150 o con los de la edición más reciente de las normas de la Technical Association of the Pulp and Paper Industry:
Muestreo de¡ papel para ensayo ISOIR 186- 1968 (2a edición)
Condiciones de¡ papel para ensayo ISOIR 187-1961
Pesos unitarios ISOIR 58-1958
Análisis de la fibra T 401
Cenizas Expediente ISO 2144
Acidez (pH), medida en frío T 435
Fuerza de ruptura Doc. ISO TC6/SC. 2. NO 405
Se puede obtener información de los métodos de la TAPPI solicitándola a la Technical Association of the Pulp and Paper Industry, 360 Lexington Avenue, New York 17, USA. Las recomendaciones de la ISO se pueden obtener en cualquier organismo nacional de la ISO
|
|
|
| Planta de maíz | Mazorca de Maíz |
|
|
 |
| Semillas de Maíz | Partes de la semilla |
 |
 |
| Diferencias en germinación entre semillas Monocotiledóneas y Dicotiledóneas | Diferencias en germinación entre semillas Monocotiledóneas y Dicotiledóneas |
 |
 |
| Semillas de Monocotiledóneas y Dicotiledóneas | Partes de una semilla germinada (plántula) |
 |
 |
|
|
Germinación en Monocotiledóneas |
Germinación en Dicotiledóneas |
|
|
|
|
|
|
Cámara de Germinación |
Placa de siembra para Tes de Germinación
|
|
|
|
|
|
| Test de Germinación en Sorgo Test de Germinación en forrajera |
Test de Germinación de Forrajera leguminosa |
Test de Germinación en Soja |
|
Observación de plántulas anormales bajo lupa |
||